购彩登录app
<tr id='tLhB7N'><strong id='tLhB7N'></strong><small id='tLhB7N'></small><button id='tLhB7N'></button><li id='tLhB7N'><noscript id='tLhB7N'><big id='tLhB7N'></big><dt id='tLhB7N'></dt></noscript></li></tr><ol id='tLhB7N'><option id='tLhB7N'><table id='tLhB7N'><blockquote id='tLhB7N'><tbody id='tLhB7N'></tbody></blockquote></table></option></ol><u id='tLhB7N'></u><kbd id='tLhB7N'><kbd id='tLhB7N'></kbd></kbd>
广东省微生物研究所揭示机器学习助力铁代谢紊乱相关疾病的早期无创辅助诊断
铁元素是个体生长、细胞代谢和免疫反应所必需的微量元素。铁稳态的失调与各种疾病的发生和发展息息相关:铁缺乏会导致宿主发育迟缓,而铁过载更易引发炎性反应, 还可能与癌症的发生发展密切相关。值得注意的是,小肠作为宿主体内铁的主要吸收场所,并不能完全将食物中的铁吸收,而相当一部分铁在结肠中与肠道菌群发生密切的交互作用,并影响肠道菌群的生态系统,从而进一步调节⊙宿主的健康和代谢。多项研究表明,铁失衡会导致肠道菌群的改变,进而改变微生物多样性,增加病原体丰度并诱导肠道炎症的发生发展。在近数十年的筛选研究中,研究人员尚未系统地研究铁与肠道菌群之间的关系,也缺〒乏无创、方便且精准评估组织中铁水平的方法。
2020年1月7日,广东省微生物研究所谢黎炜研究员所带领的肠道微生态与健康研究团队,在国际著名期刊The FASEB Journal 在线发表题为“Fecal microbiota as a noninvasive biomarker to predict the tissue iron accumulation in intestine epithelial cells and liver”的研究论文,该研究团队构建了铁紊乱小鼠,结合机器学习算法可以精确地预测肠上皮细胞和肝脏的铁水平,并可能作为一种无创方式用于铁代谢异常相关疾病的早期辅助诊断。目前相关研究成果已申请中国发明专利(专利号:201910309446)
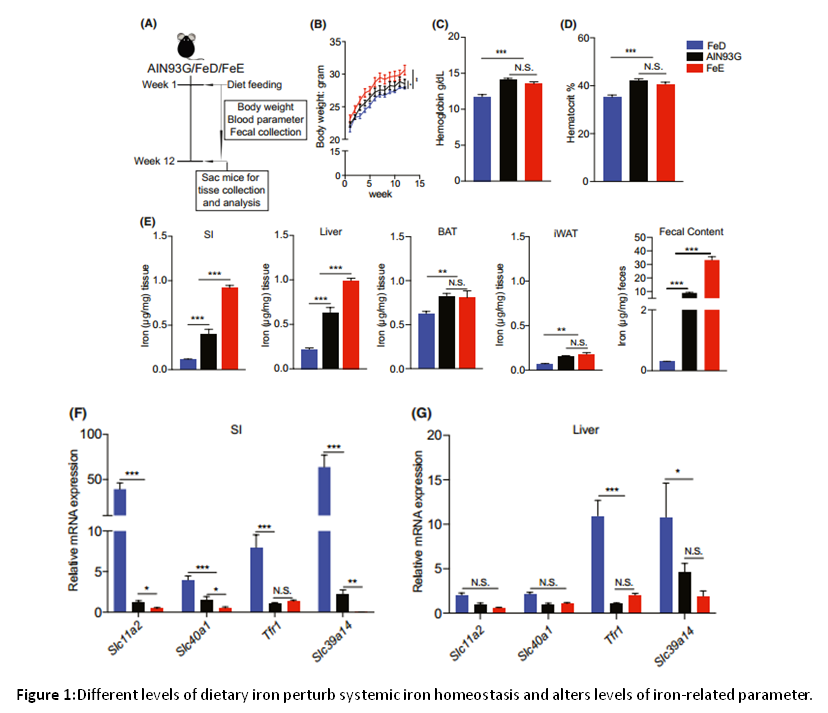
结果一:饮食中铁水平的控制扰乱了系统性铁稳态
为了了解铁介导的肠道菌群调控机制,将6周龄的C57BL / 6J小鼠以AIN93G为基础的饮食喂养了12周,以诱导铁缺乏或铁超载(Fig.1)。通过对AIN93G、FeE和FeD小鼠体重、血红蛋白、血细胞比容及格组织器官中铁含量测定,结果表明:缺铁饮食会导致小鼠生长迟缓、血红蛋白和血细胞比容降低,缺铁饮食小鼠的十二指肠(SI)、肝脏(Liver)、BAT(棕色脂肪组织)、腹股沟白色脂肪组织(iWAT)的上皮细胞中的铁含量较CK和FeD显著降低。FeE饮食仅在SI和肝脏中导致铁超载,而在BAT和iWAT中未导致铁超载。通过粪便中测定的铁含量结果可以看出,未吸收的铁通过结肠,并排入粪便。与铁运输相关的基因,例如十二指肠中的Slc11a2,Slc40a1,Slc39a14和Tfr1以及肝脏中的Tfr1和Slc39a14,都差异表达。
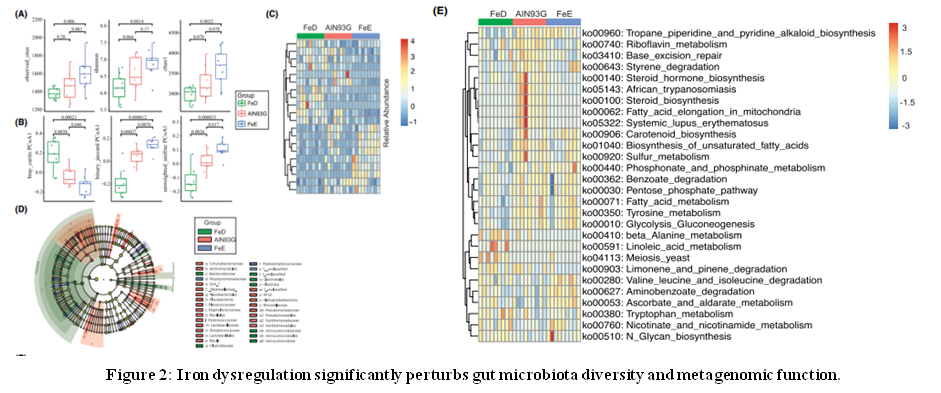
结果二:铁失调会严重干扰肠道菌群多样性和宏基因组功能
在12周的喂食期后,收集了27个粪便样品并进▲行了细菌16SV3+V4多样性测序(Fig.2),对其测序数据进行α-多样性、β-多样性、聚类热图分析,结果表明:饮食中不同的铁含量会显著改变肠道菌群的组成。组间显著性差异LEfSe分析,LDA值> 2,确定了88个显著性差异的细菌。综上,铁可能是肠道菌群组成的关键调节剂。
通过BugBase来了解肠道微生物多样性的改变是否会引起功能改变,并且在不同表型下的肠道菌群相对丰度是否有显著性差异。通过使用PICRUSt进行宏基因组功能预测来评估三组微生物群里之间的功能差异,可以看到铁水平的变◥化导致肠道微生物群落代谢的适度变化,这是针对KEGG数据库的分析的。与FeD组相比,高铁饮食喂养的小鼠的肠道中存在的类群中的脂肪酸代谢,酪氨酸代谢和糖异生稍高。亚油酸代谢,β-丙氨酸代谢,柠檬烯和pin降解途径适度改变。此外,随着整个PICRUSt数据的降维,二维空间分析表明AIN93G与其他两组显著不同(FeD P = .0056,FeE P = .03),并证明饮食引起的微生物群失调扰乱了肠道微生物群代谢的平∩衡。
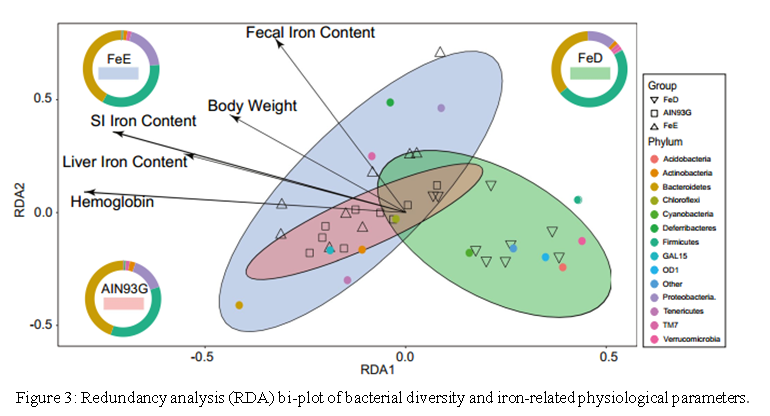
结果三:肠道菌群的改变与饮食中的铁含量和铁相关的生理参数密切相关
人们普遍认为,环境变化可能会对肠道菌群的功能和病理生理产生巨大影响,例如刺激,遗传和其他因素。尽管针对性的饮食会显著扰乱小鼠的生理生化指标,但不同处理组之间肠道菌群的差异是否与这些生理生化指数的变化有关仍是未知的。因此,本研究进行了RDA分析,以评估铁相关的生理生化指标和肠道菌群之间的关系。结果表明(Fig.3),可以使用六个环境因素来解释26.72%的方差,这表明铁水平可以在门水平显著改变肠道菌群的变化,三组样品可→清晰地分开。根据蒙特卡洛排列测试,生理参数,例如血红蛋白(P = .004),血细胞比容(P = .004),SI铁含量(P = .006)和粪便铁含量(P = .023)很高约∏束排序模型中与细菌类群的分布相关。为了进一步确认RDA分析,基于Bray Curtis距离,ANOSIM还显示Ψ了组间的差异比组内的差异更显著(R = 0.537,对于P <.0001)。RDA和ANOISM分析均证明膳食铁元素的多少在每组样品的分离和聚集中起着至关重要的作用。
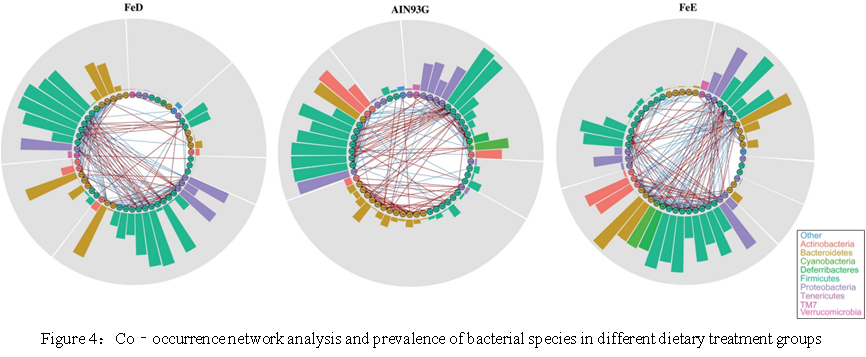
结果四:补铁扰动肠道微生物群落网络
为了确定铁是否可以影响肠道菌群群落网络,本研究使用了图论算法并进↙行了共现分析。根据Spearman的相关性,针对共现网络作图的物种分别表明,三组之间的微生物群落有显著差异(abs(r)> 0.6,P <.05,支持信息表:共现分析)。通过使用贪婪聚类方法,FeD,AIN93G和FeE组分别细分为六个,五个和五个子社区(Fig.4)。在这个网络图中,铁的存在可以重组网络,表明饮食中铁的含量可能存在阈值。如多样性分析所示,此阈值可能是影响群落结构的决定因素。
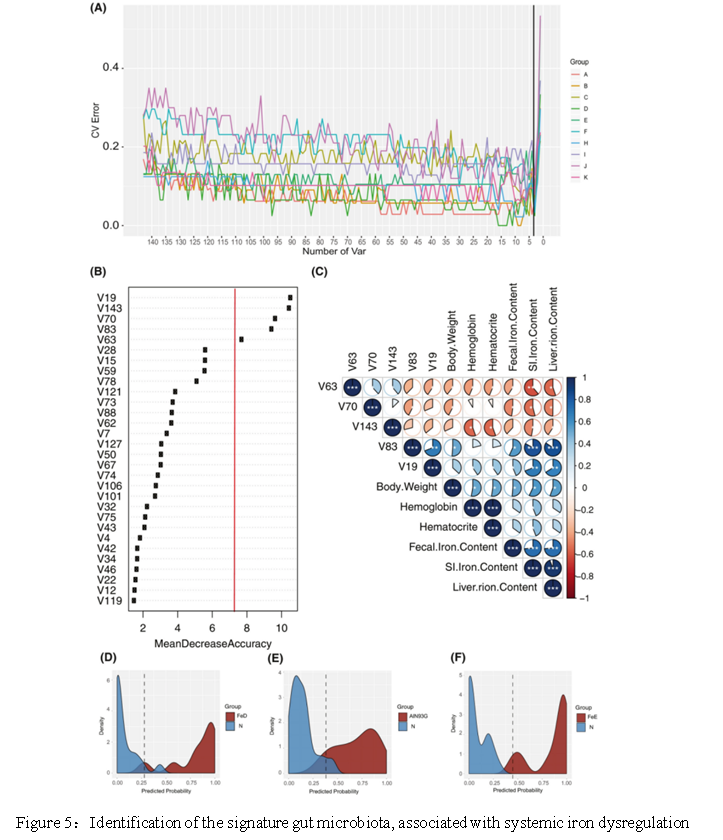
结果五:用随机森林法鉴定与全身铁失调有关的关㊣ 键细菌
本研究前面已经证明铁调节宿主的生理和代谢平衡,也显著影响微生物群落的结构。不同铁水平的饮食会导致120个细菌的相对丰度发生显著变化(Kruskal非参数检验,P <.05)。因此,很难区分它们的重要性。因此,使用随机森林算法来识别三组响应系统性铁失调的特征性菌群。通过对随机森林模型进行五重交叉验证,选择了前5个细菌作为应对铁介导的系统失调的主要分类单元(Fig.5B)。这∞些包括卟啉单胞菌(V19),梭状芽孢杆菌(C83),粘液梭菌(V143),产气荚膜梭菌(V70)和梭状梭菌(V63)。这五个关键类群与生理参数显著相关(Fig.5C)。给定五个微生物群落在社☉区中的关键位置,以应对系统性铁失调,基于它们的相对丰度建立了一个预测模型,以识别目标样品。ROC曲线表明可以很好地区分样品,其AUC值分别为99.4%,88.9%和100%(Fig.5D-F)。
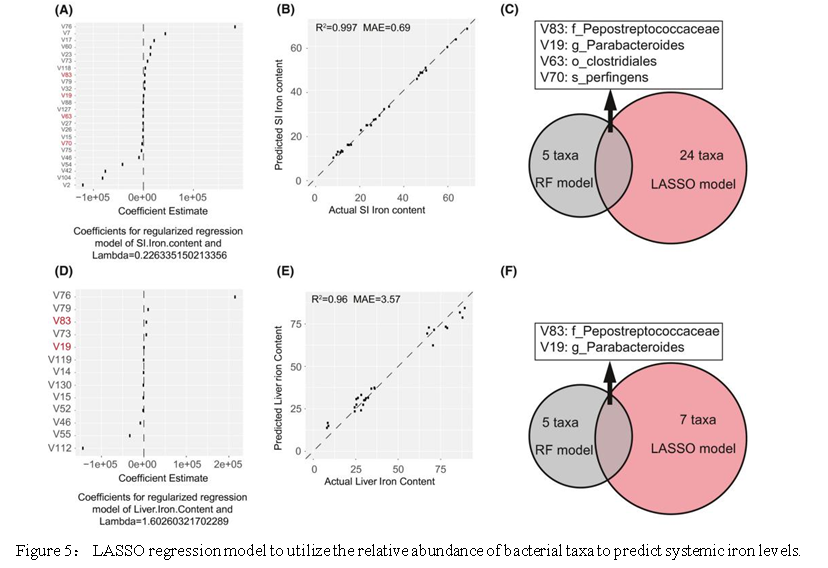
结果六:基于肠道菌群的相对丰度对全身铁状态的预测
随机森林分类器根据系※统性铁的变化确定了五个关键分类单元,这五个关键分类单元与铁相关的生理参数之间具有很强的相关性。为了推测肠道菌群的相对丰度是否可以用作预测组织铁含量的生物标记。本研究构建了LASSO回归模型,该模型可以帮助选择最佳的独立参数。使用LASSO回归模型中的lambda(λ),确定了关键分类单元,以建立每个环境因子的预测模型(Fig.6A,D)。利用这些模型预测SI,肝脏和粪便中铁的含量以及血红蛋白的R2分别为99.7%,96%,65%和67%(图6B,E)。最重要的是,SI和肝脏中的铁含量可以高度预测。使用包括随机森林和LASSO回归模型在内的两个机器学习模型,将两个模型中的关键分类单元合并以用作关键分类单元来预★测SI和肝脏种铁的含量(Fig.6C,F)。
结论
铁在氧气运输,新陈代谢和免疫防御中起着基本作用。在人类中,小肠每天吸收2至3 mg铁,其余的铁进入结肠,由肠道菌群利用。但是,粪便和全身性铁水平如何影响肠道菌群的体内平〖衡,仍然未知。为了了解铁对肠道菌群的影响,收集了C57BL / 6J小鼠的粪便样品,并评估了它们的微生物多样性和宏基因组功能。在本研ζ 究中,已经表明饮食中的铁水平是导致肠道菌群改变的关键因素。最重要的是,基于机器学习算法,建立了预测模型,该模型有助于识别关键分类单元以应对系统性铁质挑战。通过利用这些新发○现的生物标记,可以准确预测小肠和肝脏中的铁含量,R2分别为99.7%和99.6%。这些发现提供了有关系统性铁稳态与肠道功能之间联系的精确信息。
附件下载:

